Questão
Q602264
Prova: Concurso Pol?cia Civil - AC 2008 - Perito Criminal ?rea Qualquer ?rea de Forma??o - Centro de Sele??o e de Promo??o de Eventos UnB (CESPE) do ano 2008
•
Polícia Civil - AC 2008
Aproximadamente 140 milhões de toneladas de gás amoní...
Aproximadamente 140 milhões de toneladas de gás amoníaco são produzidos anualmente pelo processo de Haber, que combina nitrogênio retirado do ar com gás hidrogênio, conforme representa a equação não-balanceada a seguir. O gás amoníaco é matéria-prima para a produção de ácido nítrico e NH4NO3, este último empregado como fertilizante e explosivo.
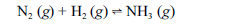
Considerando as informações acima e sabendo que M(H) = 1 g/mol e M(N) = 14 g/mol, julgue os itens a seguir.
Borbulhando-se NH3 em água, a solução resultante forma um ácido de Arrhenius.Comentários
Faça login para participar da discussão.
Cadastre-se Gratuitamente
Carregando comentários...