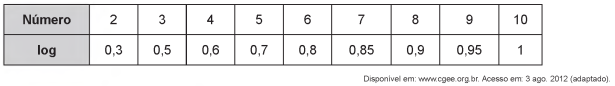
O sulfeto de mercúrio(ll) foi usado como pigmento vermelho para pinturas de quadros e murais. Esse pigmento, conhecido como vermilion, escurece com o passar dos anos, fenômeno cuja origem é alvo de pesquisas. Aventou-se a hipótese de que o vermilion seja decomposto sob a ação da luz, produzindo uma fina camada de mercúrio metálico na superfície. Essa reação seria catalisada por íon cloreto presente na umidade do ar.
WOGAN, T. Mercury's Dark Influence on Art. Disponível em: www.chemistryworld.com. Acesso em: 26 abr. 2018 (adaptado).
Segundo a hipótese proposta, o íon cloreto atua na decomposição fotoquímica do vermilion