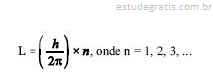Ernest Rutherford, após a experiência de bombardeio de um...
Ernest Rutherford, após a experiência de bombardeio de uma fina folha de ouro por partículas ", propôs o modelo planetário, ou nuclear, para o átomo. Este modelo apresentava uma séria dificuldade: o eletromagnetismo clássico previa que uma carga elétrica acelerada (no caso, um elétron em órbita) irradiava energia eletromagnética e, então, o elétron deveria espiralar, entrando, assim, a matéria em colapso, e tal não ocorria. Niels Bohr propôs um novo modelo que contornava este problema, postulando a existência de estados estacionários do átomo onde não haveria emissão de radiação pelo elétron ali instalado. Ele impôs uma condição para o momento angular L do elétron em órbita, expressa por ,
e h é a constante de Planck. Com relação ao modelo do átomo de Bohr, julgue os seguintes itens.
I Cada linha no espectro de emissão do átomo de hidrogênio pode ser atribuída a uma transição entre dois estados estacionários.
II As séries espectrais obtidas por Lyman, Balmer e Paschen, em laboratório, puderam ser explicadas considerando-se transições entre os estados iniciais representados por n = 1, n = 2 e n = 3, respectivamente, e o estado final com n64 .
III A energia cinética de um elétron em órbita estacionária é positiva e a energia potencial elétrica é negativa, então, a energia total pode ser positiva.
IV A máxima energia emitida por um elétron em um átomo de hidrogênio corresponde a uma transição entre um estado em que ele está inicialmente livre e um estado final em que ele estará ligado, ou seja, no estado fundamental.
Estão certos apenas os itens
Comentários
Faça login para participar da discussão.
Cadastre-se Gratuitamente